
Innenraum-Schadstoffe · Umweltberatung · Information · Schadstoff-Forschung
 |
Institut
für Angewandte Umweltforschung e.V. Innenraum-Schadstoffe · Umweltberatung · Information · Schadstoff-Forschung |
DEHP (Di(2-ethylhexyl)phthalat) gehört zur Gruppe der Phthalsäureester (Phthalate) und ist als Reinsubstanz bei Raumtemperatur eine farblose Flüssigkeit. In Tabelle 1 sind einige wesentliche chemische und physikalische Eigenschaften von DEHP aufgeführt.
Tabelle 1. Chemische und physikalische Eigenschaften von Di-(2-ethylhexyl)phthalat (NTP-CERHR 2000)
| CAS-Nr. | RN 117-81-7 |
| Summenformel / Molekulargewicht | C24H38O4 / 390,62 |
| Wasserlöslichkeit | 3 µg/L (praktisch unlöslich) |
| Schmelzpunkt / Siedepunkt | -47°C / 386°C |
| Dampfdruck | 1,0 x 10-7 mm Hg bei 25°C |
| Spezifisches Gewicht | 0,986 |
| Chemische Struktur | 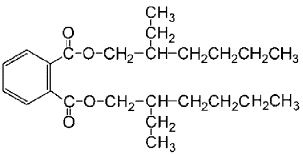 |
DEHP ist der klassische Weichmacher für PVC und andere Kunststoffe. Produkte aus diesen Materialien können 20 bis 80% DEHP enthalten. Bereits seit 1930 wird DEHP als Weichmacher eingesetzt (Höhr und Abel 1989). In Bezug auf seine Einsatzmenge ist DEHP bis heute von allen Phthalaten das wichtigste. In Deutschland wurden 1995 ca. 250.000 Tonnen DEHP produziert, wobei 114.000 Tonnen im Inland verbraucht wurden. Der weltweite jährliche Verbrauch liegt bei über 2 Millionen Tonnen (Koch et al. 2003a).
Weil das DEHP nur physikalisch im Kunststoff gebunden ist, entweicht es langsam in die Atmosphäre oder wird bei Kontakt mit Flüssigkeiten oder Fetten aus dem Kunststoff herausgelöst. Es ist heute in der Umwelt omnipräsent und bereitet im Labor beim Nachweis geringer Mengen erhebliche Schwierigkeiten.
Neben der Verwendung als Weichmacher wird DEHP in vielen weiteren Bereichen eingesetzt. Als Trägersubstanz für Duftstoffe kommt es in Parfums, Deodorants und Körperpflegemittel zur Anwendung. Es ist in Nagellacken und Haarsprays enthalten, dient als Formulierungsmittel in Pestizidanwendungen, wird als industrielles Lösungsmittel oder als Schmierstoff eingesetzt und als Additiv in der Textilindustrie verwendet (Koch et al. 2003a). Auch der medizinische Bereich kommt ohne PVC-haltige Produkte wie Blutbeutel, Infusionsbeutel, Dialysebeutel, Katheter, Schlauchsysteme, Kontaktlinsen und viele andere Medizinprodukte nicht aus (Kahl et al. 2003).
Im Innenraum und im täglichen Leben sind DEHP-haltige Produkte nicht mehr wegzudenken. Einrichtungsgegenstände, Dinge des täglichen Bedarfs oder Baumaterialien können ganz oder teilweise aus PVC bestehen bzw. DEHP enthalten. Die folgende Liste vermittelt einen Eindruck über die Verbreitung dieses Stoffes.
| Autokindersitz Autohimmel Automobilinnenteile Barbiepuppe Badezimmertextilien Bodenbeläge Couch Computer Dispersionsfarben Duschvorhang Drucker |
Dämmplatten Dachplanen Elektrokabel Faxgerät Fernseher Fugenmasse Fahrradtaschen Fahrradgriffe Gummistiefel Gartenschlauch Handy |
Kosmetikverpackung Kunstleder Kopierer Lametta Luftballon Lacke Laptop Lebensmittelverpackg. Matratze Montageschaum Monitor |
Outdoor-Kleidung Puppenkopf Plastikbuch PVC-Bodenbelag Rohre Schuhsohlen Spielzeug Teppichböden Vinyl-Handschuhe Wandbeläge |
Im Vordergrund einer gesundheitlichen Gefährdung durch DEHP stehen nach neuesten Erkenntnissen die Entwicklungs- und Reproduktionstoxizität sowie Störungen des Hormonkreislaufs (endocrine disruption). Die kanzerogene Wirkung, die in früheren Tierversuchs-Studien gefunden wurde, wird aufgrund der mangelnden Übertragbarkeit des tierischen Wirkmechanismus auf den Menschen mehr und mehr relativiert. Erste epidemiologische Daten zur Wirkung von DEHP auf den Menschen sind erst jüngst erhoben worden. So wird in einer neueren schwedischen Studie (Bornehag et al, 2004) mit erhöhter Konzentration von DEHP im Hausstaub ein Anstieg von Asthma bei Kindern beobachtet. Die meisten Befunde stützen sich jedoch nach wie vor auf Tierversuche, die hauptsächlich mit Ratte oder Maus durchgeführt wurden.
Bei inhalativer Aufnahme werden von Erwachsenen etwa 75% der zugeführten DEHP-Dosis resorbiert, während bei Kindern von 100% Bioverfügbarkeit ausgegangen wird (CSTEE 2002). Nach oraler Aufnahme wurde im Tierversuch eine Resorptionsquote von ca. 50% ermittelt (BfR 2003). Diese Quote wird von den Untersuchungen von Koch et al. (2004) unterstützt. Sie fanden, dass 47% einer DEHP-Dosis, die sie einem männlichen Erwachsenen oral applizierten, über den Urin metabolisiert ausgeschieden wurden. Es wird außerdem angenommen, dass die Empfindlichkeit gegenüber DEHP bei oraler Aufnahme höher ist im Vergleich zu parenteraler Gabe.
Im Körper wird der Di-Ester DEHP zunächst schnell zum entsprechenden Mono-Ester Mono-ethylhexylphthalat (MEHP) verstoffwechselt. Danach erfolgt ein weiterer Abbau zu Sekundärmetaboliten, die über Urin und Stuhl ausgeschieden werden. Im Blut sind DEHP-Metaboliten nur kurzzeitig nachzuweisen und ihre Konzentrationen erreichen bereits nach 4 Stunden wieder Ausgangswerte (Biologische Halbwertszeit ca. 30 min bis 2 h). Deshalb wird die DEHP-Aufnahme über Stoffwechselprodukte im Urin bestimmt. Die Halbwertszeit einer aufgenommenen Dosis beträgt hier zwischen 12 und 18 Stunden (Koch et al. 2003a). Eine bedeutende Anreicherung im menschlichen Körper konnte bislang nicht festgestellt werden (NTP-CERHR 2000).
DEHP besitzt keine akute Toxizität. Aus einer Fallbeschreibung von zwei erwachsenen Männern geht hervor, dass die orale Aufnahme von 10 g DEHP zu Verdauungsstörungen führte, während eine Dosis von 5 g wirkungslos blieb (BfR 2003).
Das empfindlichste Zielorgan der Toxizität von DEHP sind bei langfristiger Aufnahme die Hoden (Testes) und die darin befindlichen Sertolizellen, die für die Bildung der Spermien verantwortlich sind. Dieser Endpunkt ist gravierend und wird in vielen Studien ausführlich dokumentiert (NTP-CERHR 2000; ATSDR 2002; BfR 2003; CSTEE 2002, 2004). Ähnlich empfindlich reagiert das Hormonsystem auf geringe DEHP-Dosen (Akingbemi et al. 2001, 2004; Butte 2004). Die toxikologische Relevanz dieser Veränderungen wird in Fachkreisen jedoch kontrovers diskutiert (Angerer und Koch 2004). Weitere Wirkungen sind funktionelle Effekte und krankhafte Gewebsveränderungen an den Nieren sowie Vergrößerungen der Leber, Veränderungen im Stoffwechsel von Leberzellen sowie Lebertumore. Diese Effekte treten jedoch erst bei 10 bis 100-fach höheren Dosen auf (BfR 2003).
Entwicklungs und Reproduktionstoxizität
DEHP beeinträchtigt in Tierversuchen die Fortpflanzungsfähigkeit und die Entwicklung
männlicher Tiere. Zu den festgestellten Störungen gehören verschiedene gewebliche
Veränderungen in den Hoden und der darin befindlichen Zellen bis hin zum kompletten
Verlust der Spermienbildung. Dabei wurde das DEHP entweder direkt über Trinkwasser und
Nahrung oder über die Muttermilch (exponierte milchgebende Weibchen) zugeführt (z.B.
Poon et al. 1997, Arcadi et al. 1998, Wolfe und Layton 2003).
Zur Berechnung einer Dosis, die vom Menschen lebenslang täglich aufgenommen werden kann, ohne dass eine gesundheitliche Beeinträchtigung zu erwarten wäre (TDI-Wert - tolerable daily intake) stützen sich neuere Berechnungen auf Studien mit entwicklungs- und reproduktionstoxischen Endpunkten. So hat die Europäische Kommission im Rahmen der Altstoffbewertung in der neuesten Risikobewertung von DEHP die Ergebnisse einer Studie von Wolfe und Layton (2003) verwendet, um einen TDI festzulegen (CSTEE 2004). Die Autoren hatten über drei Generationen Sprague-Dawley-Ratten mit DEHP-haltiger Diät gefüttert und die testikuläre und Entwicklungstoxizität überprüft. Dabei fanden sie einen NOAEL (No observed adverse effect level, höchste Dosis ohne unerwünschte Effekte) von 4,8 mg/kg KG/d. Die Ergebnisse dieser Studie werden robuster eingeschätzt als die bis 2002 favorisierte Studie von Poon et al. (1997) (CSTEE 2002, 2004).
Hormonelle Aktivität
Phthalate können antiöstrogen und antiandrogen wirken. Die Konzentrationen, die im
Tierversuch erste Effekte verursachen, liegen dabei oft unterhalb der Konzentrationen für
entwicklungs- bzw. reproduktionstoxische Effekte. So fanden Akingbemi et al. (2001, 2004)
für männliche Long-Evans-Ratten im präpubertären Alter einen NOAEL von 1 mg/kg KG/d.
Ab 10 mg/kg KG/d stellten sie veränderte Testosteronspiegel, erhöhte Aktivität der
Leydig-Zellen sowie eine erhöhte Estradiol-Produktion fest und schließen aus ihren
Experimenten auf eine indirekte östrogene Wirkung von DEHP. Um eine sichere Abschätzung
des endokrinen Potenzials des DEHP und der anderen Phthalate treffen sowie die
toxikologische Wirkung auf den Menschen bewerten zu können, stehen jedoch weitere
Untersuchungen aus (Angerer und Koch 2004).
Kanzerogenität und genetische Toxizität
Im Tierversuch ist DEHP krebserregend. Die Übertragbarkeit dieses Befundes auf den
Menschen wird jedoch immer stärker angezweifelt, da sich die Ergebnisse aus Studien an
Maus und Ratte bei höheren Tieren wie Affen nicht bestätigen. Außerdem werden immer
mehr Informationen darüber gewonnen, in welchem Ausmaß sich die speziellen
Wirkmechanismen (Peroxisomenproliferation durch PPAR alpha-Induktion) bei Ratte und Mensch
unterscheiden. Die NOAEL von diesem Endpunkt liegen etwa um eine Größenordnung höher
als die entwicklungs- und reproduktionstoxikologischen Endpunkte (ATSDR 2002; CSTEE 2002).
Gentoxischen Effekte von DEHP konnten meistens nicht festgestellt werden. Das belegen Untersuchungen einer große Anzahl verschiedener Testsysteme (CSTEE 2002).
Erste epidemiologische Studien der Wirkung von Phthalaten auf den Menschen wurden von Duty et al. (2003a,b) durchgeführt. Dabei wurden Urin- und Spermienproben von 168 Männern aus Paaren mit verminderter Fruchtbarkeit untersucht. Im Urin wurden acht Phthalate analysiert, darunter der primäre DEHP-Metabolit MEHP. Bei den Spermien wurde ihre Konzentration, Beweglichkeit und DNA-Integrität ermittelt. Für MEHP und drei weitere Phthalate konnten keine signifikanten Korrelationen zwischen Phthalat-Konzentrationen und Spermien-Parametern gefunden werden, während für andere Phthalate manche Korrelationen signifikant waren. Die Autoren werten diesen Befund als Indiz für eine unterschiedliche Spermientoxizität verschiedener Phthalate.
Die toxikologische Datenlage hat zu einer Reihe von kritischen Einschätzungen und Verboten geführt. Die MAK-Werte-Kommission hat DEHP in Kategorie 4 der Krebserzeugenden Arbeitsstoffe eingestuft (Stoffe mit krebserzeugender Wirkung, bei denen genotoxische Effekte keine oder nur eine untergeordnete Rolle spielen; DFG 2003). Während die US-Umweltagentur EPA DEHP als beim Menschen wahrscheinlich Krebs erregend (Gruppe B2) einstuft, klassifiziert die Internationale Agentur für Krebsforschung (International Agency for Research on Cancer, IARC) den Stoff in ihre Kategorie 3 (Kanzerogenität konnte nur unzureichend nachgewiesen werden). Das Nationale Toxikologie Programm der USA (NTP) bewertet zusammen mit dem Zentrum für die Abschätzung der Risiken für die menschliche Reproduktion (CERHR - das Zentrum setzt sich aus allen relevanten Umweltbehörden der USA zusammen) DEHP als "ernsthaft bedenklich für die menschliche Fortpflanzung oder Entwicklung" (NTP-CERHR 2000). Im Sinne der Europäischen Wasserrahmenrichtlinie ist DEHP ein "prioritärer Schadstoff" und wird von der EU als "fortpflanzungsgefährdend" eingestuft (WWF 2004).
Seit 1999 hat die Kommission der Europäischen Gemeinschaft sechs Weichmacher in Spielzeug- und Babyartikeln für Kinder unter 3 Jahren befristet verboten (EU 1999). Bisher wurde das Verbot fristgerecht alle 3 Monate verlängert. In Kosmetika sind DEHP und Dibutylphthalat seit 2003 EU-weit verboten (EU 2003a). Ab Dezember 2004 wird die Verwendung dieser Stoffe in allen Konsumentenprodukten in der EU eingeschränkt (EU 2003b). In Österreich sind Phthalate - mit Ausnahmen - in Lebensmittelverpackungen verboten (BGBl 2003). Die Kunststoffkommission des deutschen Bundesinstituts für Risikobewertung empfiehlt, dass DEHP enthaltende Folien aus Weich-PVC, die in Kontakt mit Lebensmitteln kommen können, nicht mehr verwendet werden (BfR 2003).
Durch den massiven industriellen Einsatz von DEHP ist dieser Stoff in der Umwelt ubiquitär (überall vorhanden) und lässt sich damit in allen Medien nachweisen, denen der Mensch ausgesetzt ist.
Lebensmittel
Petersen und Breindahl (2000) analysierten Weichmacher-Gehalte (darunter DEHP) von
Lebensmitteln in Dänemark, die von einem Proband innerhalb von 24 h verzehrt wurden (n =
29). Die Lebensmittel wurden im Rahmen einer größeren Ernährungsstudie
zusammengestellt. Normalisiert auf eine tägliche Kost von 10 MJ Energie, fanden sie
durchschnittliche DEHP-Gehalte zwischen 190 und 300 µg/kg (Maximum: 1100 µg/kg). Dieses
Ergebnis deckt sich mit einer Schweizer Studie (BfR 2003). In einer Untersuchung aus
England wurden keine Gehalte über 20 µg/kg KG/d (Mikrogramm pro Kilogramm Körpergewicht
pro Tag) gefunden. Für Deutschland gibt es keine repräsentativen Daten (BfR 2003).
Babynahrung und Muttermilch
Das CSTEE (2004) zitiert eine Studie, in der 39 Proben Babynahrung von 14 verschiedenen
Marken untersucht wurden. Basierend auf der größten gefundenen Konzentration von 440
µg/kg, wurde eine Tagesdosis für ein 3 - 12 Monate altes Baby von 8 µg/kg KG/d
abgeschätzt. Petersen und Breindahl (2000) kamen bei ihrer Untersuchung von Babynahrung
und Instant-Produkten für Kinder (jeweils n = 11) auf ähnliche Ergebnisse. Ihre
ermittelte maximal mittlere Dosis betrug 7 µg/kg KG/d (Maximum: 16 µg/kg KG/d).
In Untersuchungen der Muttermilch wurde ein maximaler Gehalt von 160 µg/kg ermittelt (CSTEE 2004). Die daraus resultierenden Tagesdosen wurden zu 21 µg/kg KG/d (0 bis 3 Monate altes Baby) bzw. 8 µg/kg KG/d (3 bis 12 Monate altes Baby) errechnet.
Trinkwasser
Im Trinkwasser werden üblicherweise Gehalte bis 1 µg/L DEHP gefunden, in
Trinkwasserbrunnen auch schon Werte bis 170 µg/L (BAUCH 1991). In Holland wurden bis zu
3,5 µg/L DEHP im Trinkwasser ermittelt (ENDS 1999).
Luft und Schwebstaub
In der Risikoabschätzung der Europäischen Union für DEHP wird von einem
Worst-Case-Szenario ausgegangen (CSTEE 2004). Bei 100% Luftsättigung (5,3 µg/m³) plus
das 3-fache durch DEHP-haltigen Feinstaub wird eine Konzentration von 21,2 µg/m³
abgeschätzt. Untersuchungen zeigen jedoch, dass tatsächlich gemessene Konzentrationen um
den Faktor 10 bis 100 darunter liegen. Sheldon et al. (1993) fanden in 125 kalifornischen
Wohnungen im Mittel 0,110 µg/m³ DEHP, das 90. Perzentil betrug 0,240 µg/m³. (12 h
Messung, Aerosole und Gasphase erfasst). Die Untersuchung der Außenluft erbrachte im
Mittel 0,028 µg/m³ (90. Perzentil 0,065 µg/m³). Fromme et al. (2004) untersuchten
Berliner Wohnungen und Kindergärten. In den Wohnungen (n = 59) fanden sie für DEHP ein
95.-Perzentil von 0,39 µg/m³, in den Kindergärten wurden 1,51 µg/m³ gemessen
(95.-Perzentil).
Hausstaub
Für Hausstaub liegt ein umfangreiches Datenkollektiv vor. Trotz stark unterschiedlicher
Methoden in der Probenahme und der Analyse liegen alle Ergebnisse in einer vergleichbaren
Größenordnung. In Tabelle 2 sind ausgewählte Studien von deutschen Haushalten
aufgeführt.
| Tabelle 2. DEHP-Gehalte im Hausstaub (mg/kg). |
| Studie | n | Fraktion | Median | 90.-Perz | 95.-Perz | Bereich |
| ARGUK (2004) | 499 | 2 mm | 486 | 2190 | 3660 | 5 - 32055 |
| Fromme et al. (2004) | 30 | Feinstaub | 703 | 1542 | 231 - 1763 | |
| Becker et al. (2004) | 2 mm | 416 | 978 | 1190 | 0,2 - 7530 | |
| Butte et al. (2001) | 286 | 63 µm | 740 | 2600 | max 12000 | |
| HH (2002) | 65 | 63 µm | 600 | 1600 | ||
| Pöhner et al. (1997) | 272 | Gesamt | 450 | 1600 | 2000 | 0,7 - 8600 |
Boden
Persson et al. (1978, zitiert in IPCS 1992) fanden in Bodenproben aus Finnland einen
Maximalgehalt von 500 µg/kg. Die Proben wurden in der Nähe eines DEHP-produzierenden
Betriebes entnommen.
Kinderspielzeug
Spielzeug und Babyartikel für Kinder unter 3 Jahren dürfen in der EU seit 1999 nicht
mehr als 0,1% Gewichtsanteil Phthalate enthalten, darunter DEHP (EU 1999). Das
Inverkehrbringen von Spielzeug mit höheren Gehalten ist verboten. Produkte älteren
Datums können jedoch DEHP und andere Weichmacher abgeben. Das CSTEE (1998) schätzt, dass
bei durchschnittlicher Benutzung dieser Produkte Kleinkinder mit einem Körpergewicht von
8 kg eine Dosis von 200 µg/kg KG/d aufnehmen können.
Kleidung
Durch Bekleidung aus PVC können Weichmacher von der Haut aufgenommen werden. Es ist
jedoch sehr schwierig, diesen Expositionspfad zu quantifizieren, und jeder Versuch bleibt
spekulativ. Um dennoch einen Begriff für die Größenordnung einer möglichen Exposition
zu erhalten, hat die amerikanische Kommission für Produktsicherheit (U.S. Consumer
Product Safety Commission, CPSC) die Mengen abgeschätzt, welche an dem Weichmacher DINP
unter bestimmten Bedingungen durch das Tragen von Regenmänteln bzw. Sandalen aus PVC von
Kindern und Erwachsenen aufgenommen werden können (CPSC 2001). In Ermangelung an
entsprechenden Daten für DEHP wird analog zu CSTEE (1998) angenommen, dass die Ergebnisse
für DINP auch für DEHP gelten (Tabelle 3).
| Tabelle 3. Dermale DEHP-Exposition durch Tragen Weichmacherhaltiger Bekleidung. Rahmenbedingungen Regenmantel Kleinkind: 400 cm² exponierte Fläche, 4 h pro Tag an 30 Tagen im Jahr. |
| Alter | Körpergewicht | Produkt | Exposition (µg/kg KG/d)* |
|
| Erwachsener | 70 kg | Regenmantel | 0,45* - 11* | |
| Kleinkind | 1,5 - 3 Jahre | 10 kg | Regenmantel | 3,2 - 79 |
| Erwachsener | 70 kg | Sandalen | 3,9 - 98 | |
| Kleinkind | 1,5 - 3 Jahre | 10 kg | Sandalen | 14 - 340 |
| *je nach verwendetem Expositionsmodell (CPSC 2001) |
Vinyl-Handschuhe
Auch durch das Tragen von Vinyl-Handschuhen kann DEHP aufgenommen werden. Das BfR
schätzt, dass bei täglichem mehrstündigen Tragen solcher Handschuhe zwischen 3 und 119
µg/kg KG/d je nach verwendetem Rechenmodell aufgenommen werden können (BfR 2003). Das
CSTEE (2002) führt als Ergebnis einer Studie eine Aufnahmemenge von 6,7 µg/kg KG/d an.
Eine große Anzahl von Medizinprodukten wie Schlauchmaterial oder Blut- und Infusionsbeutel können DEHP enthalten. Durch den vielfältigen Einsatz im Krankenhaus kann auf diesem Wege DEHP über alle Pfade (inhalativ, oral, dermal und intravenös) in besonderem Maße aufgenommen werden. Neben Hämolyse-Patienten ist die Situation für Früh- und Neugeborene äußerst Besorgnis erregend. Bei ihnen führen Schlauchmaterialien für Ernährung, Beatmung, extrakorporale Membranoxygenation (ECMO) und Infusionen zu stark erhöhten Expositionen. Kahl et al. (2003) zitieren tägliche Belastungen von mindestens 5000 µg/kg KG/d (Daten von Loff et al. 2000 bei 2 kg KG und 100% Resorption) bzw. an anderer Stelle 1800 µg/kg KG/d. Diese Werte reichen an Konzentrationen, die im Tierversuch bereits Schädigungen zeigten, heran oder überschreiten diese (Poon et al. 1997; Wolfe und Layton 2003). Da Krankenhausaufenthalte jedoch eine außergewöhnliche Lebenssituation darstellen, wird dieses Thema hier nicht weiter behandelt.
Zur Abschätzung der gesamten äußeren Exposition gegenüber DEHP für Erwachsene und Kinder wurden für beide Personengruppen Rahmenparameter festgelegt, die in Tabelle 4 zusammengefasst sind. Die Standard-Annahmen für ein Kleinkind beziehen sich auf ein Alter von ca. 12 Monate. In diesem Alter ist von einer maximalen Staubaufnahme durch "Hand-in-den-Mund"-Verhalten (engl. Mouthing oder Picking) auszugehen, während die Ernährung meist noch auf besonderer Babynahrung basiert. Während Nahrung, Trinkwasser und Luft selbstverständlich täglich aufgenommen werden, ist dies bei Hausstaub und Boden nicht der Fall. Hier wurde eine auf das Jahr verteilte Exposition abgeschätzt. Die folgende Berechnung (Tabellen 4 bis 10) setzt konservative Rahmenbedingungen. Die tatsächliche Belastung kann je nach Grundannahmen auch um ein Vielfaches höher liegen.
| Tabelle 4. Standard-Annahmen für die Abschätzung der äußeren Exposition gegenüber DEHP für Erwachsene und Kleinkinder |
| Erwachsener | Kleinkind | |
| Körpergewicht (KG) | 75 kg | 10 kg |
| Inhalativer Aufnahmepfad | ||
| Atemrate | 20 m³/d | 6 m³/d |
| Resorptionsquote1) | 75% | 100% |
| Oraler Aufnahmepfad | ||
| Resorptionsquote2) | 50% | 50% |
| Aufnahmerate Staub | 20 mg/d | 100 mg/d |
| Expositionshäufigkeit Staub | 100 d/a | 300 d/a |
| Aufnahmerate Boden | 20 mg/d | 100 mg/d |
| Expositionshäufigkeit Boden | 50 d/a | 100 d/a |
| Trinkwasser-Tagesverzehr | 2 L/d | 1 L/d |
| 1) CSTEE 2002; Gundert-Remy 2004 |
| 2) Koch et al. 2003a; BfR 2003 |
| Tabelle 5. Tägliche DEHP-Aufnahme über die Nahrung. |
| DEHP-Zufuhr (µg/d) |
DEHP-Zufuhr pro kg KG (µg/kg KG/d) |
DEHP-Aufnahme pro kg KG (µg/kg KG/d) |
DEHP-Aufnahme (µg/d) |
|
| Erwachsener | 300* | 4,0 | 2,0 | 150 |
| Kleinkind | - | - | 7,0** | - |
| * Maximaler Mittelwert für einen Erwachsenen (Petersen und Breindahl 2000) |
| ** Maximaler Mittelwert von Fertignahrung für ein Kleinkind (Petersen und Breindahl 2000) |
| Tabelle 6. Tägliche DEHP-Aufnahme über das Trinkwasser |
| DEHP-Gehalt (µg/L)* |
DEHP-Zufuhr (µg/d) |
DEHP-Zufuhr pro kg KG (µg/kg KG/d) |
DEHP-Aufnahme pro kg KG (µg/kg KG/d) |
DEHP-Aufnahme (µg/d) |
|
| Erwachsener | 3,5 | 7,0 | 0,093 | 0,047 | 3,5 |
| Kleinkind | 3,5 | 3,5 | 0,35 | 0,18 | 1,8 |
| * Maximalwert, der in Trinkwasser in Holland gefunden wurde (ENDS 1999) |
| Tabelle 7. Tägliche DEHP-Aufnahme über die Luft |
| DEHP-Gehalt (µg/g)* |
DEHP-Zufuhr (µg/d) |
DEHP-Zufuhr pro kg KG (µg/kg KG/d) |
DEHP-Aufnahme pro kg KG (µg/kg KG/d) |
DEHP-Aufnahme (µg/d) |
|
| Erwachsener | 0,39* | 7,8 | 0,10 | 0,078 | 5,9 |
| Kleinkind | 0,39* | 2,3 | 0,23 | 0,47** | 2,3 |
| * 95.-Perzentil der Studie von Fromme et al. (2004). Es wurden 59 Berliner Wohnungen untersucht. |
| ** Die berechnete DEHP-Aufnahme wurde zusätzlich mit 2 multipliziert, um das höhere Atemminutenvolumen von Kindern zu berücksichtigen (Straff 2004). |
| Tabelle 8. Tägliche DEHP-Aufnahme über den Hausstaub |
| DEHP-Gehalt (µg/g)* |
DEHP-Zufuhr (µg/d) |
DEHP-Zufuhr pro kg KG (µg/kg KG/d) |
DEHP-Aufnahme pro kg KG (µg/kg KG/d) |
DEHP-Aufnahme (µg/d) |
|
| Erwachsener | 978* | 5,4 | 0,072 | 0,036 | 2,7 |
| Kleinkind | 978* | 81 | 8,1 | 4,0 | 40 |
| * 90.Perzentil im Umwelt-Survey 1998 (Becker et al. 2002) |
| Tabelle 9. Tägliche DEHP-Aufnahme über den Boden |
| DEHP-Gehalt (µg/g)* |
DEHP-Zufuhr (µg/d) |
DEHP-Zufuhr pro kg KG (µg/kg KG/d) |
DEHP-Aufnahme pro kg KG (µg/kg KG/d) |
DEHP-Aufnahme (µg/d) |
|
| Erwachsener | 500* | 1,4 | 0,018 | 0,0092 | 0,69 |
| Kleinkind | 500* | 14 | 1,4 | 0,69 | 6,9 |
| * Persson et al. (1978, zitiert in IPCS 1992) |
In Tabelle 10 wird die DEHP-Gesamtexposition abgeschätzt, indem die DEHP-Aufnahmen für Lebensmittel, Trinkwasser, Luft, Hausstaub und Boden summiert werden. Die Aufnahme von DEHP über diese Medien stellt eine Grundbelastung dar, die sich nicht oder nur beschränkt durch individuelles Verhalten beeinflussen lässt. Die dermale Exposition durch Produkte des täglichen Bedarfs (z.B. Kinderspielzeug, Bekleidung, Vinylhandschuhe) wurde in die Abschätzung der Grundlast nicht mit einbezogen, da die Exposition individuell stark variieren kann, je nach Art und Beschaffenheit der Bekleidung, den Tragegewohnheiten und einer Vielzahl weiterer Faktoren, die den Übergang vom Material auf die Haut bestimmen. Da die individuelle DEHP-Aufnahme um ein Vielfaches steigen kann, wenn solche Produkte benutzt werden (vgl. Abschnitt 5.3.), ist es wenig sinnvoll, sie auf einen Durchschnitt herunter zu rechnen und der Grundlast hinzuzufügen.
| Tabelle 10. DEHP-Grundlast für Erwachsene und Kleinkinder. Summe der täglichen DEHP-Aufnahme über die Expositionspfade Nahrung, Trinkwasser, Luft, Hausstaub und Boden |
| DEHP-Zufuhr (µg/d) |
DEHP-Zufuhr pro kg KG (µg/kg KG/d) |
DEHP-Aufnahme pro kg KG (µg/kg KG/d) |
DEHP-Aufnahme (µg/d) |
|
| Erwachsener | 322 | 4,3 | 2,2 | 163 |
| Kleinkind | - | - | 12 | - |
Die Abschätzung deckt sich gut mit den Angaben anderer Autoren. Doull et al. (1999) rechen mit einer durchschnittlichen Belastung der Allgemeinbevölkerung aus Umweltbelastungen von 3 bis 30 µg/kg KG/d. MAFF (1996) geben als 97,5. Perzentil 27 µg/kg KG/d an, während Meek und Chan (1994) für die Altersgruppe der 20- bis 70-jährigen 5,8 µg/kg KG/d annehmen.
Aus unserer Abschätzung wird deutlich, dass Kleinkinder in einem viel größeren Maße durch DEHP belastet werden als Erwachsene. Die von ihnen täglich resorbierte DEHP-Dosis von 12 µg/kg KG/d liegt um das 6-fache über der von Erwachsenen. Auch dieses Ergebnis wird von anderen Autoren bestätigt. Meek und Chan (1994) schätzen bei 0,5- bis 4-jährigen die tägliche Aufnahme auf 19 µg/kg KG/d. Diese Altersgruppe ist ihren Berechnungen nach am höchsten belastet und beträgt das 3,3-fache der Belastung von Erwachsenen. Gleichzeitig ist sie die empfindlichste Subpopulation.
Koch et al. (2003b) haben den Urin von 85 Individuen aus dem süddeutschen Raum (Alter 7 - 64) auf sekundäre Stoffwechselprodukte (Metaboliten) von DEHP untersucht, um daraus deren gesamte DEHP-Aufnahme zu berechnen. Die Untersuchung von DEHP-Sekundärmetaboliten (5OH-MEHP und 5oxo-MEHP) ist neu und mit wesentlich geringeren Fehlern behaftet als ältere Methoden, die auf der Bestimmung von primären Metaboliten (MEHP bzw. 2-Ethylhexanol) basieren. Insbesondere vermeidet die neue Methode Verfälschungen, die durch mit DEHP verunreinigtem Laborgerät hervorgerufen werden. Die Autoren fanden wesentlich höhere Belastungen als bisher angenommen. Während Studien, die auf der MEHP-Analytik basieren, ein 95. Perzentil von um die 3 µg/kg KG/d angeben (z.B. Kohn et al. 2000, David et al. 2000), fanden Koch et al. (2003b) Werte, die um mindestens eine Zehnerpotenz höher liegen (Tabelle 11).
Möglicherweise neigt diese Untersuchung jedoch zu einer Überschätzung der inneren Belastung, da von den gemessenen Sekundärmetaboliten auf die DEHP-Belastung mit Faktoren hochgerechnet wurde, die von Schmidt und Schlatter (1985) ermittelt wurden. In einer neuen Untersuchung zur Metabolisierung von DEHP fanden Koch et al. (2004), dass im Urin wesentlich mehr DEHP-Metaboliten ausgeschieden werden (47%), als Schmidt und Schlatter fanden (10-25%).
| Tabelle 11. Tägliche Aufnahme der Allgemeinbevölkerung (Erwachsene) an DEHP, berechnet aus unterschiedlichen Bestimmungsmethoden (µg/kg KG/d). |
| Autor | Median | 95. Perz. | Bereich | Methode |
| Koch et al. (2003b) | 13,8 | 52,1 | 2,6 - 166 | Sekundärmetaboliten |
| Kohn et al. (2000) | 0,71 | 3,6 | < BG - 46 | MEHP |
| David et al. (2000) | 0,6 | 3,05 | < BG - 38,5 | MEHP |
Dass Kinder höher belastet sind als Erwachsene konnte von Koch et al. (2003c) ebenfalls bestätigt werden. Nach einer Untersuchung von Kindergartenkindern und deren Eltern wurde festgestellt, dass die Kinder signifikant höhere Gehalte an DEHP-Sekundärmetaboliten im Urin aufwiesen. Im Vergleich lagen die Mittelwerte, Mediane und 95.-Perzentile bei den Kindern um den Faktor 1,5 bis 1,9 höher.
Der Befund von Koch et al. (2003b) weist darauf hin, dass die äußere Belastung möglicherweise höher ist als bislang angenommen und damit Lücken in der Abschätzung der äußeren Belastung existieren.
Auf der Basis von Studien an Tieren haben verschiedene Institutionen Aufnahmemengen an DEHP berechnet, die sie beim Menschen für noch tolerabel halten. Die Ergebnisse unterscheiden sich um mehr als eine Zehnerpotenz (Tabelle 12).
Der niedrigste TDI wird vom niederländischen Nationalen Institut für Volksgesundheit und Umwelt (RIVM) angegeben. Er basiert auf der Studie von Poon et al. (1997), die einen NOAEL von 3,7 mg/kg KG/d im Versuch mit Ratten ermittelt hatten (vgl. Abschnitt 4.3.1. Entwicklungs- und Reproduktionstoxizität). Als Endpunkt wurde in dieser Studie die Schädigung (Vakuolisierung) von Sertolizellen in den Hoden untersucht. Da dieses Ergebnis vom RIVM als relevant sowohl für männliche Jungtiere als auch erwachsene Tiere eingestuft wird, wurde bei der Berechung des TDI ein Unsicherheitsfaktor von 10 angewendet, um auf eine lebenslange Exposition zu extrapolieren. Ein Unsicherheitsfaktor von 100 wurde verwendet, um die inter- und intraspezifische Variation zu berücksichtigen. Mit diesen Faktoren gelangte man zu einem TDI von 4 µg/kg KG/d. Dieser TDI wird vom RIVM als "hoch verlässlich" eingestuft. Das bedeutet, dass die Autoren die toxikologische Datenbasis zu DEHP als relativ vollständig einstufen, dass ausreichende Daten insbesondere zur chronischen Toxizität vorliegen, und dass international ein ausreichender Konsens besteht in Bezug auf die toxischen Effekte (Baars et al. 2001). Am TDI des niederländischen RIVM wird deshalb im nächsten Abschnitt die in Abschnitt 6. abgeschätzte Exposition von Kleinkindern gemessen.
Wir halten dieses Vorgehen auch dadurch für legitimiert, dass DEHP bis auf weiteres der einzige phthalatische Weichmacher ist, dessen Aufnahme durch den Mensch genauerer Beobachtung unterliegt. In der Risikoabschätzung steht er deshalb einstweilen nicht nur für sich alleine, sondern hat auch Stellvertreterfunktion für eine Vielzahl weiterer industriell genutzter Phthalate. Koch et al. (2003b) haben gezeigt, dass zusammen mit DEHP oft weitere Phthalate in hohen Konzentrationen im Urin nachgewiesen werden können. Dabei gehen Koch et al. (2003a) von einer gleichgerichteten, additiven toxischen Wirkung dieser Verbindungen aus. Ein möglicherweise überschätzter Sicherheitsabstand bei DEHP könnte also eine möglicherweise unterschätzte Phthalat-Gesamtaufnahme kompensieren.
| Tabelle 12. Richtwerte verschiedener Institutionen zur tolerierbaren DEHP-Aufnahmemenge |
| Land / Institution | Richtwert (µg/kg KG/d) |
Bezeichnung | Endpunkt | Autor |
| Niederlande: Rijksinstituut voor Volksgezondheid en Milieu (RIVM) | 4 | TDI (MPR) | Reproduktionstoxizität (Schädigung Sertolizellen) | Baars et al. 2001 |
| USA: Environmental Protection Agency (EPA) | 20 | RfD | Erhöhtes Lebergewicht | IRIS 2004 |
| World Health Organization (WHO) | 25 | TDI | Peroxisomen-Proliferation in der Leber | WHO 1996, zitiert nach Baars et al. 2001 |
| EU: Scientific Committee on toxicity, ecotoxicity and the environment (CSTEE) | 48 | TDI | Entwicklungstoxizität und testikuläre Toxizität | CSTEE 2004 |
| Deutschland: Umweltbundesamt | 50 | TRD | Lebertoxizität | Hassauer et al. 1993, zitiert nach Baars et al. 2001 |
| USA: Agency for Toxic Substances and Disease Registry | 60 | MRL | Testikuläre Toxizität | ATSDR 2002 |
| TDI: Tolerable Daily Intake; MPR: Maximum Permissible Risk Level; RfD:
Reference Dose (für chronische orale Exposition); TRD: Tolerierbare resorbierte Dosis; MRL: Minimal Risk Level (für chronische orale Exposition) |
Eine Exposition von Kleinkindern gegenüber DEHP in der Höhe von 12 µg/kg KG/d ist nicht ungewöhnlich, wie die Expositionsabschätzung in Abschnitt 6. zeigt. Mit einer solchen Grundbelastung wird der TDI des RIVM um das 2-fache überschritten. In Tabelle 13 ist die Verteilung der einzelnen Pfade auf die Grundbelastung dargestellt.
Nicht mit eingegangen in diese Abschätzung ist die Belastung durch das Lutschen oder Kauen von DEHP-haltigem Kinderspielzeug oder das Tragen von Kleidung aus PVC wie Regenmäntel, Gummistiefel oder Sandalen. Das über diesen Weg freigesetzte und aufgenommene DEHP übersteigt selbst bei normaler Benutzung die Grundbelastung um ein Vielfaches: Durch das Lutschen oder Kauen von Kinderspielzeug können bis zu 200 µg/kg KG/d aufgenommen werden (CSTEE 1998). Über die Haut können täglich bis zu 79 (Regenmantel) bzw. 340 (Sandalen) µg/kg KG/d aufgenommen werden (CPSC 2001).
| Tabelle 13. Zusammensetzung der gesamten täglichen DEHP-Aufnahme (Grundbelastung) aus den einzelnen Expositionspfaden beim Kleinkind (µg/kg KG/d). |
| Nahrung | Trinkwasser | Luft | Staub | Boden | Gesamt | |
| Tagesdosis | 7 | 0,175 | 0,144 | 4 | 0,7 | 12 |
| Anteil | 58,3% | 1,4% | 1,2% | 33,3% | 5,8% | 100% |
Nach ihrer Bedeutung gewichtet ergibt sich daher für die Expositionspfade folgendes Bild:
Kleidung und Kinderspielzeug > Nahrung > Hausstaub > Boden > Trinkwasser > Luft
Die Belastung durch DEHP-haltiges Kinderspielzeug stellt eine der wichtigsten und intensivsten Belastungsquellen dar. Deshalb wurde 1999 DEHP-haltiges Spielzeug und Babyartikel für Kinder unter 3 Jahren EU-weit verboten (EU 1999). Altes Spielzeug, das aus PVC besteht, oder dessen Materialart nicht bekannt ist, sollte deshalb nicht "weitervererbt" und weiterverwendet werden! Beim Neukauf außerhalb Europas sollte auf Kennzeichnungen wie "PP" (Polypropylen) oder "PE" (Polyethylen) geachtet werden. Diese Materialien sind weniger bedenklich.
Die Belastung durch DEHP-haltige Kleidung besitzt einen ähnlich hohen Stellenwert wie das Kinderspielzeug. Trotzdem ist dieser Bereich noch nicht reguliert. Man sollte deshalb PVC-haltige Produkte, die bei Kindern in direktem Kontakt mit der Haut stehen können, auf jeden Fall vermeiden und nach Alternativen suchen! Diese bestehen zum Beispiel im Kauf von Gummistiefeln aus echtem Gummi oder Jacken aus gewachster Baumwolle. Auch Polyester und Polyamid sind als Bekleidungsmaterial weniger schädlich.
Der Nahrungspfad stellt im Rahmen der Grundbelastung die wichtigste Belastungsquelle dar und führt für sich alleine zu einer Überschreitung des TDI um 75%. Eine Regulation dieses Pfades wird aber zunehmend in Angriff genommen, wie eine Reihe neuer Verordnungen belegen. Darunter fallen z.B. die EU-weite Beschränkung der Verwendung von Weichmachern in Konsumentenprodukten ab Dez 2004 oder das Verbot von vielen Phthalaten in Lebensmittelverpackungen in Österreich (EU 2003b).
Die Möglichkeit der persönlichen Einflussnahme auf die DEHP-Aufnahme durch die Nahrung ist stark beschränkt. Bei dem Versuch, Lebensmittel zu meiden, die in Kunststoff verpackt sind, kann die Palette der akzeptablen Nahrungsmittel stark eingeschränkt sein. Prinzipiell empfiehlt es sich dort einzukaufen, wo die Transportketten kurz sind (z.B. beim Direkterzeuger) und die Lebensmittel nicht aufwändig verpackt und lange aufbewahrt werden müssen, oder der bevorzugte Einkauf von losem Gut.
Der Hausstaubpfad alleine schöpft ebenfalls den TDI vollständig aus. Insgesamt stellt er die zweitwichtigste Belastungsmöglichkeit dar, kann aber bei Kindern mit stärkerem Hand-zu-Mund-Verhalten schnell zur wichtigsten Belastungsquelle aufsteigen und den TDI-Wert um ein vielfaches überschreiten. Calabrese et al. (1989) fanden, dass solche Kinder mehr als 1 g Hausstaub pro Tag verschlucken können.
Die Möglichkeit der persönlichen Einflussnahme auf die DEHP-Aufnahme durch den Hausstaub ist relativ groß. Die wichtigste Maßnahme besteht in der Vermeidung von PVC-Böden und anderen PVC-haltigen Produkten und Baumaterialien. Darüber hinaus kann häufiges Wischen und Beseitigen des Staubes die Exposition gegenüber DEHP maßgeblich reduzieren.
Die anderen Pfade (Trinkwasser, Luft, Boden) beanspruchen zusammen nur 8,4% der Gesamtbelastung und sind deshalb wenig bedeutend.
Somit stellt der Hausstaub den zweitwichtigsten Aufnahmepfad für Kleinkinder dar mit Tendenz hin zum wichtigsten. Eine Regulierung dieses Pfads hat bisher jedoch noch nicht stattgefunden. Im Abschnitt 10. schlagen wir deshalb die Etablierung eines toxikologisch begründeten Richtwerts für die DEHP-Belastung des Hausstaubes vor.
Wir haben mit dem TDI des RIVM einen niedrigen TDI gewählt (Tabelle 12). Andere Organisationen berechnen TDIs, die um etwa eine Größenordnung höher liegen können. Wäre das vorgestellte Szenario der äußeren Exposition weniger kritisch einzustufen, wenn man einen höheren TDI zur Beurteilung wählen würde? Das hier vorgestellte Expositionsszenario geht von eher konservativen Annahmen aus. Bei der Wahl von Rahmenbedingungen, die in stärkerem Maße Extremfälle berücksichtigen (z.B. Wahl von Maximalkonzentrationen in Lebensmitteln oder im Hausstaub), oder von ungünstigeren Voraussetzungen ausgehen (z.B. Einbezug der dermalen Exposition in die Grundlast, eine 100%ige orale Resorption bei Kindern oder eine höhere Staubaufnahme), gelänge man leicht zu 10-fach höheren Expositionen und damit in einen Bereich, in dem auch höhere TDIs ausgeschöpft werden.
Ein Richtwert zur Begrenzung der DEHP-Belastung von Hausstäuben ist erforderlich, um die Bedeutung dieses Expositionspfades für Kleinkinder ins öffentliche Bewusstsein zu rücken. Er könnte zum Motor für eine verstärkte Überwachung dieser gefährlichen Belastung und so zu Präventionsmaßnahmen, anspruchsvolle und effiziente Entstaubung und Quellenvermeidung führen. Ein solcher Richtwert wäre ein Beitrag zur Gefahrenabwehr sowie für die Gesundheitsförderung.
Wir schlagen deshalb einen Richtwert für DEHP-Belastungen des Hausstaubes für Kleinkinder vor von
100 µg DEHP/g Hausstaub
Dieser Vorschlag orientiert sich an der Maßgabe, dass von einem Expositionspfad möglichst nicht mehr als 10% der Tolerierbaren Resorbierten Dosis (TRD) beansprucht werden sollen: 100 µg/g ergäben bei einer angenommenen täglichen Hausstaub-Aufnahme von 100 mg durch Kleinkinder eine DEHP-Zufuhr von 10 µg/d, die einer resorbierten DEHP-Aufnahme von 5 µg/d entsprächen. Bei einer unterstellten relevanten Exposition an 300 Tagen im Jahr ergäbe das übers Jahr eine resorbierte DEHP-Aufnahme von 4,1 µg/d. Dieser Tagesdosis entspricht bei einem Kleinkind mit 10 kg Körpergewicht eine Körperdosis von 0,41 µg/kg KG/d. Das wären ca. 10% des TDI-Wertes von 4 µg/kg KG/d. Ein Richtwert für Kleinkinder für DEHP im Hausstaub in gleicher Höhe ist bereits von der Arbeitsgemeinschaft ökologischer Forschungsinstitute e.V. (AGÖF) aufgestellt worden, wenn auch ohne toxikologische Begründung (AGÖF 2004).
AGÖF (2004) AGÖF-Orientierungswerte für Inhaltsstoffe von Raumluft und Hausstaub. Umwelt & Gesundheit 1/2004:6-13
Akingbemi BT, Youker RT, Sottas CM, Ge R, Katz E, Klinefelter GR, Zirkin BR, Hardy MP (2001) Modulation of rat Leydig cell steroidogenic function by Di(2-ethylhexyl)phthalate. Biology of reproduction 65:1252-1259
Akingbemi BT, Ge R, Klinefelter GR, Zirkin BR, Hardy MP (2004) Phthalate-induced Leydig cell hyperplasia is associated with multiple endocrine disturbances. Proceedings of the National Academy of Sciences 101(3):775-780
Angerer und Koch (2004) Phthalate (Phthalsäurediester). Webseite: www.arbeitsmedizin.uni-erlangen.de/Koch_Phthalate.htm, zuletzt besucht am 15.06.2004
Arcadi FA, Costa C, Imperatore C, Marchese A, Rapisarda A, Salemi M, Trimarchi GR, Costa G (1998) Oral toxicity of Bis(2-ethylhexyl)phthalate during pregnancy and suckling in the Long-Evans Rat. Food and Chemical Toxicology 36(11):963-970
ARGUK (2004) Untersuchung von 499 Stäuben auf Diethylhexylphthalat (DEHP) im Zeitraum 1999 - 2004. Anlassbezogene Probenahme, unveröffentlichte Labordaten.
ATSDR (2002) Toxicological Profile for Di(2-ethylhexyl)phthalate. US Department of Health and Human Services, Public Health Service, Agency for Toxic Substances and Disease Registry.
Baars AJ, Theelen RMC, Janssen PJCM, Hesse JM, van Apeldoorn ME, Meijerink MCM, Verdam L, Zeilmaker MJ (2001) Re-evaluation of human toxicological Maximum Permissible Risk levels. Rijksinstituut voor Volksgezondheid en Milieu (RIVM), Bilthoven. RIVM report 711701025
BAUCH (1991) Weichmacher in Innenräumen. Materialien zur Umweltberatung 12/91. Beratung und Analyse Verein für Umweltchemie e.V., Wilsnacker Str. 15, 1000 Berlin 21
Becker K, Kaus S, Krause C, Lepom P, Schulz C, Seiwert M, Seifert B (2002) Umwelt-Survey 1998 Band V. Hausstaub: Stoffgehalte im Hausstaub aus Haushalten der Bevölkerung in Deutschland. WaBoLu-Hefte 1/02. Hrsg: Umweltbundesamt, Postfach 330022, 14191 Berlin
BfR (2003) Tägliche Aufnahme von Diethylhexylphthalat (DEHP). Stellungnsahme des BfR vom 23. Juli 2003. www.bfr.de/...
BGBl (2003) Kunststoffverordnung, Bundesgesetzblatt 2003/476, Teil A, Anlage 1
Bornehag CG, Sundell J, Weschler C, Sigsgaard T, Lundgren B, Hasselgren M, Hägerhed-Engman L (2004) The Association between Asthma and Allergic Symptoms in Children and Phthalates in House Dust: A Nested Case-Control Study. Environmental Health Perspectives 112(14): 1393-1397
Butte W, Hoffmann W, Hostrup O, Schmidt A, Walker G (2001) Endokrin wirksame Substanzen im Hausstaub: Ergebnisse eines repräsentativen Monitorings. Gefahrstoffe - Reinhaltung der Luft 61(1/2):19-23
Butte W (2004) Phthalate in Innenräumen. Vortrag auf den 11. WaBoLu-Innenraumtagen, 17. - 19.5.2004. Institut für Wasser-, Boden- und Lufthygiene, Berlin
Calabrese EJ, Pastides H, Barnes R, Edwards C, Kostecki PT, Stanek III EJ, Veneman P, Gilbert CE (1989) How much soil do young children ingest: an epidemiological study. Regulatory Toxicology and Pharmacology 10:129-137
CPSC (2001) Report to the U.S. Consumer Product Safety Commission by the Chronic Hazard Advisory Panel on Diisononyl Phthalate (DINP), June 2001. U.S. Consumer Product Safety Commission, Directorate for Helath Sciences, Bethesda, MD 20814.
CSTEE (2002) Opinion on the results of the Risk Assessment of: Bis(2-ethylhexyl)phthalate (DEHP) Opinion expressed at the 29th plenary meeting, Brussels, 09 January 2002
CSTEE (2004) Opinion on the results of a second Risk Assessment of: Bis(2-ethylhexyl)phthalate [DEHP] Human Health Part, 41th plenary meeting of 8 January 2004
DFG (2003) MAK- und BAT-Werte-Liste 2003. Maximale Arbeitsplatzkonzentrationen und Biologische Arbeitsstofftoleranzwerte. Senatskommission zur Prüfung gesundheitsschädlicher Arbeitsstoffe, Mitteilung 39. Deutsche Forschungsgemeinschaft, Bonn.
Doull J, Cattley R, Elcombe C, Lake BG, Swenberg J, Wilkonson C (1999) in Koch et al. 2003
Duty MS, Singh NP, Silva MJ, Barr DB, Brock JW, Ryan L, Herrick RF, Christiani DC, Hauser R (2003a) The relationship between environmental exposures to phthalates and DNA damage in human sperm using the Neutral Comet Assay. Environmental Health Perspectives 111(9):1164-1169
Duty SM, Silva MJ, Barr DB, Brock JW, Ryan L, Chen Z, Herrick RF, Christiani DC, Hauser R (2003b) Phthalate exposure and human semen parameters. Epidemiology 14(3):269-277
ENDS (1999) Industry glimpses new challenges as endocrine science advances. Environmental Data Services (ENDS). Report 290:26-30
EU (1999) Entscheidung der Kommission der Europäischen Gemeinschaften vom 7. Dezember 1999 (1999/815/EG).
EU (2003a) Richtlinie 2003/15/EG, Kosmetikrichtlinie
EU (2003b) Directives 76/769 Anhang I, 67/548 Anhang I, 88/379. Österreichische Chemikalienverbotsverordnung 2003/477 Teil II.
Fromme H, Lahrz T, Piloty M, Gebhart H, Oddoy A, Rüden H (2004) Occurrence of phathalates and musk fragrances in indoor air and dust from apartments and kindergartens in Berlin (Germany). Indoor Air 14(3):188
Gundert-Remy U (2004) Kinderspezifische Sicherheitsfaktoren bei der Ableitung von Grenzwerten. Umweltbedingte Gesundheitsrisiken Teil II. Hrsg.: Umweltbundesamt, Postfach 330022, 14191 Berlin. Download: www.umweltbundesamt.de
HH (2002) Schwerflüchtige organische Umweltchemikalien in Hamburger
Hausstäuben. Hrsg.: Freie und Hansestadt Hamburg (HH), Umweltbericht 61/2002.
Höhr D, Abel J (1989) Zur Toxikologie des Phthalsäuredialkylesters DEHP. Umwelthygiene
22:93-109
IPCS (1992) Diethylhexyl Phthalate - Environmental Health Criteria 131. International Programme on Chemical Safety, World Health Organization, Genf. Download: www.inchem.org/documents/ehc/ehc/ehc131.htm
IRIS (2004) Integrated Risk Information System. Summary of Di(2-ethylhexyl)phthalate (DEHP); oral RfD assessment dated May 1991. US Environmental Protection Agency, Washington DC, USA.
Kahl R, Degen G, Foth H, Kramer P-J, Lilienblum W, Schrenk D, Schulz T, Schweinfurth (2003) Stellungnahme der Beratungskommission der Sektion Toxikologie der Deutschen Gesellschaft für experimentelle und klinische Pharmakologie und Toxikologie (DGPT) zu möglichen Gesundheitsgefahren durch Di(2-ethylhexyl)phthalat (DEHP) aus Medizinprodukten in neonatalogischen Intensivstationen. Umweltmedizin in Forschung und Praxis 8(1):25-30
Koch HM, Drexler H, Angerer J (2003a) Die innere Belastung der Allgemeinbevölkerung mit Di(2-ethylhexyl)phthalat (DEHP). Umweltmedizin in Forschung und Praxis 8(1):15-23
Koch HM, Drexler, H, Angerer J (2003b) An estimation of the daily intake of di(2-ethylhexyl)phthalate (DEHP) and other phthalates in the general population. International Journal of Hygiene and Environmental Health 206:77-83
Koch HM, Drexler H, Angerer J (2003c) Di(2-ethyl)hexylphthalat (DEHP)-Belastung von Kindergartenkindern im Vergleich zu Erwachsenen - Biologisches Monitoring spezifischer DEHP-Sekundärmetabolite in Urin. Umweltmedizin in Forschung und Praxis 8(4):190Koch HM, Bolt HM, Angerer J (2004) Di(2-ethylhexyl)phthalate (DEHP) metabolites in human urine and serum after a single oral dose of deuterium-labelled DEHP. Archives of toxicology 78:123-130
Loff S, Kabs F, Witt K, Sartoris J, Mandl B, Niessen KH, Waag KL (2000) Polyvinylchloride infusion lines expose infants to large amounts of toxic plastizisers. J Pediatr Surg 35:1775-1781
MAFF, Department of Health and the Scottish Executive, Joint Food Safety and Standards Group (1996) Maff UK - Phthalates in food. Food surveillance information Sheet 82, March 1996
Meek ME, Chan PKL (1994) Bis(2-ethylhexyl)phthalate: evaluation of risks to health from environmental exposure in Canada. Journal of Environmental Science and Health Part C 12, 179-194
NTP-CERHR (2000) NTP-CERHR expert panel report on Di(2-ethylhexyl)phthalat. Federal Register 65(196), S. 60206 (erhältlich auf der CERHR-Website: http://cerhr.niehs.nih.gov)
Persson PE, Penttinen H, Nuorteva P (1978) DEHP in the vicinity of an industrial area in Finland. Environmental Pollution 16:163-166
Petersen JH, Breindahl T (2000) Plasticizers in total diet samples, baby foos and infant formulae. Food Additives and Contaminants 17(2):133-141
Pöhner A, Simrock S, Thumulla J, Weber S, Wirkner T (1997) Hintergrundbelastung des Hausstaubes von Privathaushalten mit mittel- und schwerflüchtigen organischen Schadstoffen. Zeitschrift für Umweltmedizin 6:337-345
Poon R, Lecavalier P, Mueller R, Valli VE, Procter BG, Chu I (1997) Subchronic oral txicity of di-n-octyl phthalate and di(2-ehtylhexyl)phthalate in the rat. Food and Chemical Toxicology 35(2):225-239
Sheldon L, Whitaker D, Keever J, Clayton A, Perrit R (1993) Phthalates and PAHs in indoor and outdoor air in a Southern California community. Proceedings of Indoor Air Vol. 3
Straff W (2004) Was ist bei Kindern anders als bei Erwachsenen? Umweltbedingte Gesundheitsrisiken Teil I. Hrsg.: Umweltbundesamt, Postfach 330022, 14191 Berlin. Download: www.umweltbundesamt.de
Wolfe GW, Layton KA (2003) Multigeneration reproduction toxicity study in rats (unaudited draft): Diethylhexylphthalate: Multigenerational reproductive assessment by continuous breeding when administered to Sprague-Dawley rats in the diet. TherImmune Research Corporation (Gaithersburg, Maryland), TRC Study No 7244-200
WWF (2004) Faktenblätter zu nachgewiesenen Chemikalien in der WWF
Blutprobenuntersuchung von Europaparlamentariern. www.wwf.de/imperia/md/content/pdf/umweltgifte/Blutuntersuchung
_Europaparlamentarier_-_Gifte.pdf, zuletzt besucht am 20.07.2004
Home | Inhalt
| Über uns | Haftungsausschluss
| Gesundes Nest | Fertighaus
| Reiz- und Riechstoffe | Trinkwasser
Schadstoffbibliothek | Dienstleistungen | Pressemitteilungen | Diplomarbeiten | Kontakt